لنفوسیت T چیست؟ – به زبان ساده
سیستم ایمنی با دو دسته مکانیسمهای ذاتی و اکتسابی از ورود ویروس، باکتری، انگل و قارچ به سلولها و تکثیر این پاتوژنها در بدن جلوگیری میکند. پوست، مخاط و آنزیم لیزوززیم اولین سد دفاعی ایمنی ذاتی است. اگر پاتوژن از این سد عبور کند، بهوسیله گلبولهای سفید شناسایی شده و با فاگوسیتوز از بین میروند.
سیستم ایمنی با دو دسته مکانیسمهای ذاتی و اکتسابی از ورود ویروس، باکتری، انگل و قارچ به سلولها و تکثیر این پاتوژنها در بدن جلوگیری میکند. پوست، مخاط و آنزیم لیزوززیم اولین سد دفاعی ایمنی ذاتی است. اگر پاتوژن از این سد عبور کند، بهوسیله گلبولهای سفید شناسایی شده و با فاگوسیتوز از بین میروند. پروتئینهای کمپلمان بخش دیگری از ایمنی ذاتی هستند که با ایجاد کانالهای غشایی پاتوژنها را از بین میبرند. اگر پاتوژن بهوسیله این مکانیسمها از بین نرود، مکانیسمهای اکتسابی فعال میشوند. لنفوسیت T و B، گلبولهای سفید ایمنی اکتسابی هستند که آنتیژنها را به طور اختصاصی شناسایی میکنند. لنفوسیت B با ترشح آنتیبادی احتمال فاگوسیتوز یا از بین رفتن پاتوژنها بهوسیله سیستم کمپلمان را افزایش میدهد. لنفوسیت T با القای آپوپتوز سلولهای آلوده به ویروس و باکتریها را از بین میبرند. در این مطلب انواع لنفوسیت T را به همراه مکانیسم فعالیت و تفاوت آن با لنفوسیت B بررسی میکنیم.
لنفوسیت T چیست؟
لنفوسیتهای T گلبولهای سفید اصلی در ایمنی سلولی بدن هستند که همراه لنفوسیتهای B در دفاع اختصاصی شرکت میکنند. لنفوسیتهای T سلولهایی کوچک (۸ تا ۱۰ میکرومتر) با هستهای بزرگ هستند که پس از فعال شدن قطر آنها افزایش مییابد. این سلولها در بافتهای لنفاوی و محیطی سلولهای آلوده به پاتوژن و سرطانی را شناسایی میکنند و با القای آپوپتوز این سلولها را از بین میبرند. لنفوسیت T در مغز استخوان تولید و در تیموس بالغ میشود. این سلولها در حین تکامل نسبت به مولکولهای سطحی سلولهای خودی غیرفعال میشوند.
گیرنده های لنفوسیت T
گیرنده لنفوسیت T مجموعهای از پروتئینهای عرضی غشای این سلولها است که آنتیژن متصل به مولکولهای ویژه سازگاری بافت (MHC) را شناسایی میکند. جایگاه اتصال به آنتیژن این گیرندهها متفاوت و اختصاصی است. گیرندههای لنفوسیت T از دو زنجیره پلیپپتیدی آلفا و بتا یا گاما و دلتا تشکیل شده است که بهوسیله پیوندهای دیسولفیدی به هم متصل میشوند. هر یک از این زنجیرههای گلیکوپروتئینی از دو دومین خارج غشایی، یک دومین بین غشایی و یک دومین سیتوزولی تشکیل شده است. ناحیه ثابت و متغیر دومینهای خارج غشایی گیرنده لنفوسیت T هستند. جایگاه اتصال به آنتیژن در ناحیه متغیر این گیرنده قرار دارد و بیشتر با آنتیژنهای پپتیدی متصل میشود.
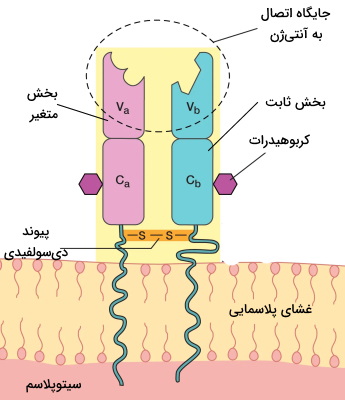
دو مولکول CD3 و دو زنجیره پلیپپتیدی زتا با پیوند غیرکووالانسی به گیرنده آنتیژنی لنفوسیت T متصل است که در انتقال پیام نقش دارند و به آنتیژن وصل نمیشود. CD3 از سه زنجیره گاما، دلتا و اپسیلون تشکیل شده که به شکل دو مولکول جدا از هم اپسیلون-گاما و اپسیلون-دلتا در غشا قرار دارند. در هر زنجیره CD3 یک موتیف تیروزین و در هر زنجیره زتا سه موتیف تیروزین وجود دارد. پس از اتصال آنتیژن به گیرنده فعال شدن کینازهای سلولی و فسفوریلاسیون موتیفهای تیروزین به فعال شدن مسیر انتقال پیام درون سلول کمک میکند. CD28 و CD40 گلیکوپروتئینهای دیگر غشای لنفوسیتهای اولیه هستند که اتصال آنها به پروتئینهای غشای سلولهای ارائهدهنده آنتیژن، به فعال شدن لنفوسیت کمک میکند.
گیرنده های گاما دلتا
گیرندههای گاما-دلتا مثل گیرندههای آلفا-بتا از موتیفهای ثابت و متغیر تشکیل میشود. اما تنوع جایگاه متغیر این گیرندهها کمتر از نوع آلفا-بتا است. این گیرنده در غشای لنفوسیتهای بافت مخاطی پوست، معده و ریهها وجود دارد و سریعتر از سلولهای T آلفا-بتا پاسخ ایمنی ایجاد میکند. این گیرندهها آنتیژنهای لیپیدی را شناسایی و با سنتز اینترفرون گاما، فاکتور نکروز تومور (TNF) و القای آپوپتوز پاتوژن را از بین میبرند. برخلاف سلولهای T آلفا-بتا، لنفوسیت T خاطره از فعال شدن سلولهای T گاما-دلتا تولید نمیشود.
انواع لنفوسیت T
لنفوسیتهای T بر اساس عملکرد به انواع کشنده، کمککننده و تنظیمی تقسیم میشوند.
- لنفوسیت T کشنده: لنفوسیتهای T کشنده در پاسخ به آنتیژن متصل به MHCI فعال میشود. گلیکوپروتئین کمکگیرنده در غشای این سلولها CD8 با دو زنجیره پلیپپتیدی است و در غشای تمام سلولهای هستهدار بدن وجود دارد. CD8 به مولکولهای MHCI متصل میشود. وظیفه اصلی این سلولها از بین بردن سلولهای آلوده به ویروس است اما به از بین بردن باکتریهای درونسلولی و سلولهای توموری کمک میکنند.
- لنفوسیت T کمککننده: لنفوسیت T کمککننده (Th) در پاسخ به آنتیژن متصل به MHCII در غشای سلولهای ارائهدهنده آنتیژن (سلولهای دندریتی، ماکروفاژها، سلول B و سلولهای اپیتلیال تیموس) فعال میشود. گلیکوپروتئین کمککننده گیرنده در غشای این سلولها CD4 است که به مولکولهای MHCII وصل میشود. این سلولها با آزاد کردن سیتوکینها و فعال کردن سایر گلبولهای سفید به سیستم ایمنی کمک میکند. دو نوع لنفوسیت T کمککننده در سیستم ایمنی وجود دارد.
- Th1 در پاسخ به پاتوژنهای درونسلولی (ویروس و باکتری) از فعال شدن سلول T اولیه بهوسیله IL12 تولید میشود. این سلولها با سنتز $$INF-gamma$$ و IL2 ماکروفاژها، سلولهای T کشنده و سلولهای کشنده طبیعی را فعال میکند.
- Th2 در پاسخ به کرمهای انگلی از فعال شدن سلول T اولیه بهوسیله IL-4 تولید میشود. این سلولها با سنتز IL4، IL-5 و IL3 سایر گلبولهای سفید را فعال میکند. IL4 و IL3 مسیرهای تولید آنتیبادیهای E و G در سلولهای B و IL5 ائوزینوفیل را فعال میکند.
- لنفوسیت T تنظیمی: لنفوسیتهای T تنظیمی (Treg) از تمایز سلولهای اجدادی مشترک با سلولهای T کمککننده تولید میشود و پروتئینهای CD4 در غشای آن وجود دارد. CD25 و FOXP3 پروتئینهای غشایی هستند که لنفوسیتهای T تنظیمی را از لنفوسیتهای کمککننده متمایز میکنند. وظیفه این لنفوسیتها مهار تولید سلولهای کشنده و کمککننده است و در پیشگیری از بیماریهای خودایمنی نقش دارند.
بلوغ لنفوسیت T
لنفوسیتهای T از تمایز سلولهای بنیادی خونساز تولید میشود. در مرحله اول تمایز سلولهای خونساز به سلولهای اجدادی میلوئیدی و لنفوئیدی تبدیل میشود. از تمایز سلولهای میلوئیدی مگاکاریوسیت، اریتروسیت، ماستسل و میوبلاست ایجاد میشود. مگاکاریوسیتها به پلاکت تبدیل شده و از تمایز میوبلاست گلبولهای سفید بازوفیل، نوتروفیل، ائوزینوفیل و مونوسیت تشکیل میشود. از تمایز سلولهای لنفوئیدی سلولهای کشنده طبیعی و لنفوسیتهای کوچک ایجاد میشود.
بخشی از لنفوسیتهای کوچک در مغز استخوان بالغ شده و به لنفوسیت B تبدیل میشود و بخش دیگر آن بهوسیله خون به غده تیموس منتقل و پس از بلوغ به لنفوسیتهای T تبدیل میشود. کاهش اندازه غده تیموس پس از سن بلوغ سبب کاهش تولید لنفوسیتهای T میشود. لنفوسیتهای T بهوسیله دو فرایند انتخاب مثبت و منفی بر اساس پروتئینهای غشایی به انواع مختلف تقسیم و نسبت به آنتیژنهای سطح سلولهای خودی خنثی میشود.
گلیکوپروتئینهای CD (پروتئین تمایز دسته | Cluster of Differentiation) به گیرنده لنفوسیت در شناسایی آنتیژن کمک میکنند. CD4 و CD8 دو پروتئین اصلی در تقسیمبندی لنفوسیتها است. در غشای لنفوسیتهای T که وارد تیموس میشود، پروتئینهای CD4 و CD8 وجود ندارد. در مراحل اولیه بلوغ این دو پروتئین سنتز و در غشای لنفوسیت قرار میگیرد و در مراحل بعدی یکی از این دو پروتئین حذف شده و سلولهای $$CD^{4+}$$ یا $$CD^{8+}$$ از تیموس به گرههای لنفاوی، لوزهها، طحال و سایر بافتهای لنفاوی ثانویه منتقل میشود.
انتخاب مثبت
در انتخاب مثبت عملکرد صحیح گیرندههای آنتیژنی سلولهای T بررسی میشود. در این فرایند گیرنده لنفوسیتهای T نابالغ با مولکولهای MHCI و MHCII در غشای سلولهای اپتلیال قشر تیموس برهمکنش میدهد. اگر گیرنده لنفوسیت T به یکی از این مولکولهای متصل شود، سلول مراحل بعدی بلوغ را طی میکند و اگر گیرنده به هیچ کدام از مولکولها متصل نشود، مسیر آپوپتوز فعال میشود.
سلولهایی که به مولکولهای MHCII متصل شدند به لنفوسیتهای T کمککننده ($$CD^{4+}$$) تمایز مییابند. پیام سلولهای تیموس بیان پروتئینهای CD8 در این سلولها را کاهش میدهد. سلولهایی که به مولکولهای MHCI متصل شدند به لنفوسیت T کشنده ($$CD^{8+}$$) تمایز مییابند. در این سلولها بیان پروتئینهای CD4 کاهش مییابد. در این فرایند بخشی از سلولهای $$CD^{4+}$$ که به آنتیژن خودی متصل میشود، به سلولهای T تنظیمی تمایز مییابد.
انتخاب منفی
در انتخاب منفی حساسیت گیرنده آنتیژنی لنفوسیت T به آنتیژنهای خودی بررسی میشود. لنفوسیتهایی که در انتخاب مثبت زنده ماندند به مدولای تیموس منتقل میشوند و در این بخش با آنتیژنهای خودی متصل به مولکولهای MHC در غشای سلولهای اپیتلیال تیموس برهمکنش میدهند. اگر بین گیرنده لنفوسیت T و آنتیژن اتصال محکمی ایجاد شود، مسیر آپوپتوز فعال و سلول از بین میرود. این فرایند از ایجاد بیماریهای خودایمنی پیشگیری میکند.
عملکرد لنفوسیت T
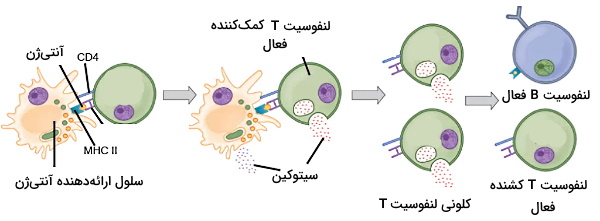
لنفوسیتهای T کمککننده، کشنده و تنظیمی عملکرد متفاوتی در سیستم ایمنی دارند. لنفوسیتهای T کمککننده آنتیژن همراه با MHCII در غشای ماکروفاژها و سلولهای دندریتی را شناسایی میکند. ماکروفاژها و نوتروفیلهای اولین گلبولهای سفیدی هستند که آنتیژن خارجی را شناسایی میکنند. این سلولها پاتوژن را فاگوسیتوز میکنند. آنتیژن پروتئینی پاتوژنها بهوسیله آنزیمهای لیزوزومی جدا شده و پس از اتصال به مولکولهای MHCII در غشای سلول قرار میگیرد. اتصال آنتیژن-MHCII به گیرندههای آنتیژنی Th، اتصال مولکول CD28 به پروتئینهای CD80 یا CD86 غشای سلولهای ارائهدهنده آنتیژن و اتصال IL2 سه سیگنال فعال شدن سلولهای Th است.
اتصال آنتیژن-MHCII به گیرندههای آنتیژنی با فعال شدن کینازهای Lck (متصل به بخش سیتوپلاسمی CD4) و Fyn (متصل به بخش سیتوپلاسمی CD3 و زنجیره زتا) همراه است. فسفوریلاسیون موتیفهای تیروزین سبب تجمع آنزیمهای دیگر در غشا و در نهایت فعال شدن فسفولیپاز C میشود. فسفولیپاز C، لیپید فسفاتیدیل اینوزیتول ۴،۵ بیس فسفات غشا را به اینوزیتول تریفسفات (IP3) و دیآسیل گلیسرول (DAG) تجزیه میکند. IP3 و DAG سه مسیر آنزیمی لنفوسیت T کمککننده را فعال میکند.
- اینوزیتول تریفسفات: اینوزیتول تریفسفات انتقال کلسیم از شبکه اندوپلاسمی صاف به سیتوپلاسم را افزایش میدهد. کلسیم به پروتئین کلسینورین متصل شده و در نهایت فاکتور رونویسی NFAT فعال میشود.
- دیآسیل گلیسرول: دیآسیل گلیسرول، آنزیم کیناز C را فعال میکند. در نتیجه فعال شدن کیناز C، فسفوریلاسیونهای متوالی پروتئینها سبب فعال شدن فاکتور رونویسی NF-kB میشود. به علاوه DAG با فعالی کردن پروتئین کیناز فعالکننده میتوز (MAP کیناز) فاکتور رونویسی AP-1 را فعال میکند.
فاکتورهای رونویسی بیان ژنهای میتوز و اینترلوکینها (ILs) به ویژه IL2 را افزیش میدهد. در نتیجه کلونی از سلولهای T کمککننده با گیرنده اختصاصی آنتیژن تشکیل میشود.
عملکرد لنفوسیت T کشنده
لنفوسیتهای T کشنده سلولهای آلوده به پاتوژن (باکتری و ویروس)، سلولهای توموری و سلولهای پیوند بافت را از بین میبرد. آنتیژن ویروسها پس از ورود به سیتوپلاسم سلول به وسیله آنزیمهای لیزوزومی از سلول جدا شده و پس از پردازش همراه مولکولهای MHCI در غشای سلول قرار میگیرد. این سلولها ممکن است سلولهای ارائهدهنده آنتیژن یا سلولهای غیرایمنی باشند. گیرنده آنتیژنی سلولهای T کشنده به این آنتیژنها وصل میشود.
با اتصال آنتیژن به گیرنده، سلولهای T تکثیر شده و کلونی از سلولها با گیرنده اختصاصی آنتیژن (سلولهای عملکننده) و سلولهای T خاطره تولید میشود. سلولهای عملکننده گرانولهای حاوی آنزیم گرانزیم و پروتئینهای پرفورین آزاد میکنند. پروتئینهای پرفورین در غشای سلول آلوده کانالهایی تشکیل میدهد. تغییر فشار اسمزی سلول به دلیل انتقال الکترولیتهای سیتوپلاسم از این کانالها با لیز شدن و مرگ سلول همراه است. سرین پروتئاز گرانزیم پس از ورود به سلول پروتئینهای مسیر آپوپتوز را فعال میکند. یکی دیگر از مکانیسمهای فعال کردن آپوپتوز در سلولهای آلوده، اتصال پروتئین FasL غشای لنفوسیت کشنده به پروتئین Fas غشای سلول هدف است. این اتصال با فعال شدن آنزیمهای کاسپاز و مرگ سلول همراه است. سلولهای T خاطره در ورود مجدد همان آنتیژن به بدن پاسخ سریعتری ایجاد میکند.
تفاوت لنفوسیت T و B
لنفوسیتهای B گروه دیگر گلبولهای سفید دفاع اختصاصی هستند که مثل لنفوسیتهای T از تمایز سلولهای رده لنفوئیدی تولید میشود اما در مغز استخوان بالغ میشود. گیرنده آنتیژنی این سلولها از آنتیبادیهای M یا D غشایی و آنتیبادیهای کمکی آلفا و بتا تشکیل شده است. آنتیبادیهای غشایی برخلاف گیرندههای لنفوسیت T از چهار زنجیره پلیپپتیدی شامل دو زنجیره سنگین با وزن مولکولی زیاد (حدود ۶۵ kDa) و دو زنجیره سبک با وزن مولکولی کم (حدود ۲۵ kDa) تشکیل شده است. هر زنجیره سبک با پیوند دیسولفیدی به یک زنجیره سبک وصل میشود و عملکردی مشابه بخش خارج سلولی گیرندههای آنتیژنی لنفوسیت T دارد. بخشی از زنجیره سنگین در غشای پلاسمایی و انتهای کربوکسیلی آن در سیتوپلاسم قرار دارد.
در انتهای آمینی هر زنجیره سبک و سنگین، یک موتیف متغیر اتصالی به آنتیژن وجود دارد. به همین دلیل گیرنده لنفوسیتهای B برخلاف لنفوسیتهای T، همزمان به دو آنتیژن متصل میشود. بخش درونغشایی زنجیره سنگین آنتیبادی M از ۲۵ آمینواسید تشکیل شده و نزدیک آنزیم تیروزین کیناز قرار دارد. این موتیف به انتقال پیام داخل سلولی کمک میکند. گیرنده سلولهای B آنتیژنهای متصل به سلولهای دیگر و آنتیژنهای محلول در خون یا لنف را شناسایی میکند، اما گیرنده سلولهای T فقط به آنتیژنهای متصل به MHC پاسخ میدهد. گیرنده لنفوسیت B آنتیژنهای پروتئینی، کربوهیدرات، لیپید و DNA، اما گیرنده سلولهای T فقط آنتیژنهای پپتیدی را شناسایی میکند.
فعال شدن لنفوسیت B
لنفوسیتهای B مثل لنفوسیتهای T علاوه بر اتصال آنتیژن-آنتیبادی به عملکرد گیرندههای کمکی و سیتوکینها برای فعال شدن نیاز دارند. CD21 یکی از گیرندههای کمکی غشای لنفوسیت B است که به کمپلکس آنتیژن-پروتئینهای مکمل متصل میشود. گلیکوپروتئین CD40 یکی دیگر از گیرندههای لنفوسیتهای B است که به پروتئینهای غشایی لنفوسیت T کمککننده متصل میشود. اتصال CD40 به لیگاند سنتز سیتوکینها، کموکینها، فاکتورهای رشد، متالوآنزیمها و فاکتورهای رونویسی پروتئینهای میتوز سلول را در لنفوسیت B تحریک میکند.
انواع لنفوسیت B
لنفوسیتهای B بر اساس مولکولهای غشایی، مکانیسم فعال شدن، محل استقرار و نوع آنتیژنی که به آن پاسخ میدهند، به انواع انتقالی، بالغ، پلاسموسیت و خاطره تقسیم میشوند.
- لنفوسیت B انتقالی: لنفوسیتهای انتقالی، اولین سلولها در مراحل بلوغ لنفوسیت B هستند که پس از انتهاب منفی در مغز استخوان زنده میمانند و بهوسیله خون به طحال منتقل میشوند. در غشای پلاسمایی این سلولها آنتیبادی D و M وجود دارد.
- لنفوسیت B بالغ: لنفوسیتهای B بالغ، سلولهای B اولیه (Naïve) در اندامهای ثانویه هستند. این سلولها پس از اتصال به آنتیژن به پلاسموسیت و سلولهای B خاطره تمایز مییابد. بخشی از لنفوسیتهای B بالغ به گرههای لنفاوی و بافت لنفاوی همراه مخاط منتقل میشوند. این لنفوسیتها در فولیکول اولیه و ثانویه قرار دارند و به آنها لنفوسیت فولیکولار گفته میشود. بخشی از لنفوسیتهای بالغ به طحال منتقل شده و به سلولهای B ناحیه مرزی تمایز مییابد. فعال شدن لنفوسیتهای بالغ مرکز زاینده گرههای لنفاوی، طحال و بافت لنفاوی همراه مخاط به سلولهای T کمککننده وابسته است. لنفوسیتهای بالغ ناحیه مرزی طحال مستقل از لنفوسیتهای T کمککننده فعال میشوند.
- پلاسموسیت: پلاسموسیتها سلولهای آخرین مرحله تمایز لنفوسیتهای B هستند. آنتیبادیهای غشایی در این سلولها وجود ندارد. این سلولها آنتیبادی اختصاصی آنتیژنی را ترشح میکنند که در مرحله قبل به گیرنده لنفوسیت B بالغ متصل شده است. CD27 پروتئینهای اختصاصی این سلولها است که در غشای انواع دیگر سلول B وجود ندارد.
- سلول B خاطره: سلولهای B خاطره از فعال شپوشدن لنفوسیتهای B بالغ در مرکز زاینده اندامهای لنفاوی ثانویه تولید میشود. آنتیبادی غشایی این سلولها از انواع G، A یا E است و CD27 در غشای آنها وجود دارد. این سلولها در پاسخ به ورود مجدد آنتیژن به بدن فعال میشوند.
سوالات متداول
در این بخش از مطلب به تعدادی از سوالات متداول پیرامون لنفوسیت T پاسخ میدهیم.
آزمایش شمارش لنفوسیت T چیست؟
آزمایش شمارش لنفوسیت T بخشی از آزمایش شمارش کل گلبولهای سفید خون است. تعداد گلبولهای سفید در هر میکرولیتر خون مرد بزرگسال بین ۵۰۰۰ تا ۱۰۰۰۰، زن بزرگسال بین ۴۵۰۰ تا ۱۱۰۰۰ و کودکان ۵۰۰۰ تا ۱۰۰۰۰ است. ۲۰ تا ۴۰٪ گلبولهای سفید خون، لنفوسیتهای B و T است. تعداد لنفوسیتها در عفونتهای ویروسی، کمکاری تیروئید، استرس و سرطانهای افزایش و در بیماریهای خودایمنی و بیماران تحت رادیوتراپی و شیمیدرمانی کاهش مییابد.
لنفوسیت تراپی چیست؟
در لنفوسیتتراپی از لنفوسیتهای T خود بیمار برای درمان استفاده میشود. در این روش لنفوسیتها از خون بیمار جدا شده و پس از کشت به بدن منتقل میشود. با این کار تعداد لنفوسیتهای T از بینبرنده تومورها افزایش مییابد. به علاوه در بعضی از موارد ایجاد تغییرات ژنتیکی در لنفوسیتها قبل از انتقال به بدن، پاسخ ایمنی را تقویت میکند. در روش میتوان لنفوسیتها را از بافت توموری جدا کرد. در این حالت یلولهایی افزایش مییابند که گیرنده اختصاصی آن تومور ار دارند و کارایی درمان افزایش مییابد. تغییر ژنتیکی گیرندهها آنتیژنی سلول T یا جایگزین کردن آنها با رسپتورهایی که پروتئینهای ویژه سلولهای سرطانی را شناسایی میکنند، روشهای دیگری است که در لنوفسیتتراپی استفاده میشود.
source
برچسب ها :
ناموجود- نظرات ارسال شده توسط شما، پس از تایید توسط مدیران سایت منتشر خواهد شد.
- نظراتی که حاوی تهمت یا افترا باشد منتشر نخواهد شد.
- نظراتی که به غیر از زبان فارسی یا غیر مرتبط با خبر باشد منتشر نخواهد شد.






ارسال نظر شما
مجموع نظرات : 0 در انتظار بررسی : 0 انتشار یافته : 0